PH (I محلول مائي :
1) مفهوم المحلول :
PH محلول مقدار بدون وحدة، يُمكِّن من التمييز بين المحاليل.
تدل حمضية المحلول على تركيز عمل الايونات +H
تدل قاعدية المحلول على تركيز عمل الايونات -OH
2) قياس PH محلول :
لقياس PH محلول نستعمل :
ورقة PH :
ورق مصنوع من مادة تأخذ ألوانا مختلفة حسب طبيعة المحلول حيث ندخل الورق في المحلول فيأخذ لونا ثم نقرأُ القيمة المرافقة لهذا اللون .
جهاز PH متر :
جهاز رقمي يعطي قيمة PH على شاشة وهي قيمة دقيقة .
3) تصنيف المحاليل :
تصنف المحاليل إلى ثلاثة أَنواع : محاليل حمضية، محاليل قاعدية ومحاليل محايدة .
إِذا كان 7>PH فإِنه محلول حمضي؛
إِذا كان 7=PH فإِن المحلول محايد؛
إِذا كان 7<PH فإِنه محلول قاعدي؛
أَمثلة :
قيمة PH في الماء هي 7 إِذن الماء محلول محايد؛
قيمة PH في ماء جفيل هي 10 إِذن ماء جفيل محلول قاعدي؛
قيمة PH في ماء البحر هي 8 إِذن ماء البحر محلول قاعدي؛
قيمة PH في حمض الكلوروديك هي 3 إِذن حمض الكلوروديك محلول حمضي؛
قيمة PH في الخل هي 3 إِذن الخل محلول حمضي؛
قيمة PH في مشروب غازي هي 2,5 إِذن مشروب غازي محلول حمضي؛
قيمة PH في ماء الجير هي 9 إِذن ماء الجير محلول قاعدي؛
سلم PH :
II) الإِحتياطات الازم إِتخاذها عند إِستعمال المحاليل المؤثرة :
تتجلى أَخطار إِستعمال المحاليل الحمضية والقاعدية المركزة في تأثيرها على الصحة والبيئة، لذلك وضع الصانع لصيقات على القنينة تدل على خطورتها وعلى الاحتياطات التي يجب إِتخاذها أَثناء إِستعمالها :
أَفضل طريقة لاستعمال المحاليل المركزة هي تخفيفها وذلك باضافة القليل منها إِلى الماء وليس العكس .
1) تخفيف محلول حمضي :
تجربة :
تخفيف حمض الكلوريدريك المركز :
عند تخفيف محلول حمضي فان قيمة PH تزداد.
2) تخفيف محلول قاعدي :
تخفيف محلول الصودا :
عند تخفيف محلول قاعدي فان قيمة PH تنقص.
تطبيق :
اراد تلميذ تخفيف محلول حمضي مركز ذي PH =1
1) ماهي الاحتياطات الواجب اتخاذها ؟
2) صف طريقة التخفيف ؟
3) ما هي قيمة PH التي سيجدها، علل ؟
تصحيح :1) عدم حدوث تماس على مستوى الجلد والعينين والجهاز التنفسي .2) لتخفيف المحلول نضيف القليل من المحلول الى الماء وليس العكس .3) قيمة PH بعد التخفيف هي : 2 وكلما استمر التلميذ في تخفيف المحلول كلما استمرت قيمة في الارتفاع لانه عندما يتم تخفيف محلول حمضي تزداد قيمة .
III) تأثير حمض الكلوريدريك على الفلزات :
محلول حمض الكلوريدريك محلول حمضي له PH<7، يتكون من ايونات موجبة +H وايونات سالبة -Cl ، صيغته (-Cl ؛ +H)، ويسمى محلول كلورور الهيدروجين .
1) تجربة :
نضع في اربعة انابيب اربعة قطع من الفلزات (حديد المنيوم زنك نحاس) ثم نصب في كل انبوب قليل من محلول حمض الكلوريدريك .
2) ملاحظات :
يتفاعل حمض الكلوريدريك مع الحديد الألمنيوم والزنك ولا يتفاعل مع النحاس .
ينتج عن تفاعل حمض الكلوريدريك مع الفلزات تكون غاز وتحول الفلز الى ايونات .
الغاز المتصاعد هو ثنائي الهيدروجين ونرمز له ب H2 الذي يحدث فرقعة عند تقريبه من لهب .
ملخص هذه التفاعلات :
الفلز + حمض الكلوريدريك ---------> ثنائي الهيدروجين + ايونات الفلز
5) صياغة المعادلات الكيميائية :
معادلات التفاعلات الكيميائية :
معادلة تفاعل الحديد مع حمض الكلوريدريك :
معادلة تفاعل الزنك مع حمض الكلوريدريك :
معادلة تفاعل الألمنيوم مع حمض الكلوريدريك :
تطبيق 1 :
نريد حفظ محلول حمض الكلوريدريك المركز في أوان نتوفر على أوان من البلاستيك، النحاس و الألمنيوم .
حدد معللا جوابك الإناء المناسب لحفظ هذا المحلول ؟
تطبيق 2 :
نصب كمية من محلول حمضي في كاس بها مسامير من حديد .
1) ماذا نلاحظ عند بداية التجربة ؟
2) ما هي نواتج هذا التفاعل؟
3) اكتب معادلة التفاعل ؟
تصحيح تطبيق 1 :
لا يجب حفظ حمض الكلوريدريك في أوان من الألمنيوم لأنها تتفاعل معه .
يجب حفظ حمض الكلوريدريك في أوان من البلاستيك والنحاس لأنها لا تتفاعل معها .
تصحيح تطبيق 2 :
1) نلاحظ في بداية التجربة تصاعد فقاعات .
2) نواتج هذا التفاعل غاز ثنائي الهيدروجين وتكون ايونات الحديد الثاني التي تعطينا تلونا اخضر .
3) معادلة تفاعل الحديد هي :
IV) تأثير هيدروكسيد الصوديوم على الفلزات .
تعريف حمض هيدروكسيد الصوديوم :
محلول هيدروكسيد الصوديوم محلول قاعدي له PH>7 يتكون من أيونات +Na وايونات -OH صيغته (-Na+ ، OH)
2) تجربة :
نصب قليلا من محلول هيدروكسيد الصوديوم على أنابيب تحتوي على فلزات .
2) ملاحظة :
عدم تصاعد الفقاعات في الأنبوبين الذين يحتويان على الحديد والنحاس .
تصاعد فقاعات في الأنبوب الذي يحتوي على الألمنيوم في درجة حرارة عادية .
تصاعد فقاعات في الأنبوب الذي يحتوي على الزنك بعد التسخين .
3) استنتاج :
لا يتفاعل هيدروكسيد الصوديوم مع الحديد والنحاس .
تصاعد فقاعات يدل على حدوث تفاعل وتكون غاز .
4) خلاصة :
يتفاعل محلول هيدروكسيد الصوديوم مع الألمنيوم ومع الزنك بعد التسخين،
وينتج عن هذا التفاعل غاز ثنائي الهيدروجين وتحول الفلز إلى ايونات ؛
لا يتفاعل محلول هيدروكسيد الصوديوم مع الحديد، النحاس، البلاستيك والزجاج ؛
تطبيق :
نتوفر على محلولين احدهما حمضي والآخر قاعدي .
أعط طريقتين مختلفتين للتمييز بينهما ؟
تصحيح التطبيق :
الطريقة الأولى : قياس PH سواء باستعمال PH متر او ورق PH ،
إذا كان PH<7 فان المحلول حمضي، وإذا كان PH>7 فان المحلول قاعدي .
الطريقة الثانية : استعمال فلز الحديد .
نصب المحلولين في كأسين بهما فلز الحديد،
إذا لاحظنا تصاعد فقاعات فان المحلول الذي في الكأس حمضي وإذا لم تتصاعد فان المحلول قاعدي .
V) روائز الكشف عن بعض الايونات :
نحضر 3 محاليل : محلول الملح، محلول كبريتات النحاس الثالث ومحلول كبريتات الحديد الثاني .


1) مما تتكون المحاليل ؟
2) ما هو الفرق بين هذه المحاليل ؟
تتكون المحاليل من ايونات موجبة وايونات سالبة شحنة الايونات الموجبة تعادل شحنة الايونات السالبة .
تختلف هذه المحاليل من حيث اللون، فمحلول الملح عديم اللون، كبريتات الحديد الثاني لونه أخضر بينما كبريتات النحاس الثالث له لون أزرق تختلف ألوان المحاليل بسبب اختلاف الأيونات المتواجدة بها فبعض الأيونات تعطي ألوانا مثل +Fe 2 و+Cu 2 وأخرى لا تعطي ألوانا مثل +Na و-Cl .
1) روائز الكشف عن الأيونات الموجبة ( الكاتيونات )
المحلول الكاشف هو هيدروكسيد الصوديوم (-Na+ ، OH) وهو المستعمل للكشف عن جميع الايونات الموجبة .
أ) روائز الكشف عن ايونات الحديد الثاني +Fe 2 وايونات الحديد الثالث +Fe 3 :
نصب قليلا من هيدروكسيد الصوديوم (-Na+ ، OH) في محلولين : كبريتات الحديد الثاني ومحلول كلورور الحديد الثالث
الراسب الاخضر يسمى هيدروكسيد الحديد الثاني صيغته : Fe(OH)2 ، ويدل على وجود ايونات الحديد الثاني في المحلول، معادلة هذا الترسيب هي :
1) مفهوم المحلول :
PH محلول مقدار بدون وحدة، يُمكِّن من التمييز بين المحاليل.
تدل حمضية المحلول على تركيز عمل الايونات +H
تدل قاعدية المحلول على تركيز عمل الايونات -OH
2) قياس PH محلول :
لقياس PH محلول نستعمل :
ورقة PH :
ورق مصنوع من مادة تأخذ ألوانا مختلفة حسب طبيعة المحلول حيث ندخل الورق في المحلول فيأخذ لونا ثم نقرأُ القيمة المرافقة لهذا اللون .
جهاز PH متر :
جهاز رقمي يعطي قيمة PH على شاشة وهي قيمة دقيقة .
3) تصنيف المحاليل :
تصنف المحاليل إلى ثلاثة أَنواع : محاليل حمضية، محاليل قاعدية ومحاليل محايدة .
إِذا كان 7>PH فإِنه محلول حمضي؛
إِذا كان 7=PH فإِن المحلول محايد؛
إِذا كان 7<PH فإِنه محلول قاعدي؛
أَمثلة :
قيمة PH في الماء هي 7 إِذن الماء محلول محايد؛
قيمة PH في ماء جفيل هي 10 إِذن ماء جفيل محلول قاعدي؛
قيمة PH في ماء البحر هي 8 إِذن ماء البحر محلول قاعدي؛
قيمة PH في حمض الكلوروديك هي 3 إِذن حمض الكلوروديك محلول حمضي؛
قيمة PH في الخل هي 3 إِذن الخل محلول حمضي؛
قيمة PH في مشروب غازي هي 2,5 إِذن مشروب غازي محلول حمضي؛
قيمة PH في ماء الجير هي 9 إِذن ماء الجير محلول قاعدي؛
سلم PH :
II) الإِحتياطات الازم إِتخاذها عند إِستعمال المحاليل المؤثرة :
تتجلى أَخطار إِستعمال المحاليل الحمضية والقاعدية المركزة في تأثيرها على الصحة والبيئة، لذلك وضع الصانع لصيقات على القنينة تدل على خطورتها وعلى الاحتياطات التي يجب إِتخاذها أَثناء إِستعمالها :
- عدم حدوث تماس مباشر للمحلول مع الجلد أَو العينين أَو الجهاز التنفسي.
- تجنب تذوق أَو ابتلاع أَو إِستنشاق المحاليل المركزة.
- عدم خلط المحاليل دون معرفة خواصها.
- قراءة الإِرشادات التي يجب إِتباعها على القنينة.
- عدم صرف المحاليل المركزة في الطبيعة أَو مباشرة في حوض الغسيل.
أَفضل طريقة لاستعمال المحاليل المركزة هي تخفيفها وذلك باضافة القليل منها إِلى الماء وليس العكس .
1) تخفيف محلول حمضي :
تجربة :
تخفيف حمض الكلوريدريك المركز :
عند تخفيف محلول حمضي فان قيمة PH تزداد.
2) تخفيف محلول قاعدي :
تخفيف محلول الصودا :
عند تخفيف محلول قاعدي فان قيمة PH تنقص.
تطبيق :
اراد تلميذ تخفيف محلول حمضي مركز ذي PH =1
1) ماهي الاحتياطات الواجب اتخاذها ؟
2) صف طريقة التخفيف ؟
3) ما هي قيمة PH التي سيجدها، علل ؟
تصحيح :1) عدم حدوث تماس على مستوى الجلد والعينين والجهاز التنفسي .2) لتخفيف المحلول نضيف القليل من المحلول الى الماء وليس العكس .3) قيمة PH بعد التخفيف هي : 2 وكلما استمر التلميذ في تخفيف المحلول كلما استمرت قيمة في الارتفاع لانه عندما يتم تخفيف محلول حمضي تزداد قيمة .
III) تأثير حمض الكلوريدريك على الفلزات :
محلول حمض الكلوريدريك محلول حمضي له PH<7، يتكون من ايونات موجبة +H وايونات سالبة -Cl ، صيغته (-Cl ؛ +H)، ويسمى محلول كلورور الهيدروجين .
1) تجربة :
نضع في اربعة انابيب اربعة قطع من الفلزات (حديد المنيوم زنك نحاس) ثم نصب في كل انبوب قليل من محلول حمض الكلوريدريك .
2) ملاحظات :
- تصاعد فقاعات في الانابيب التي تحتوي علي الحديد الالمنيوم والزنك .
- يحدث تغيير في الانبوب الذي يحتوي على النحاس .
- ظهور تلون اخضر في الانبوب الذي يحتوي على الحديد .
- تصاعد الفقاعات يدل على حدوث تفاعل بين الفلز وحمض الكلوريدريك وتكون غاز .
- نستنتج أن النحاس لا يتفاعل مع حمض الكلوريدريك .
- التلون الأخضر يدل على وجود ايونات الحديد الثاني +2 Fe .
يتفاعل حمض الكلوريدريك مع الحديد الألمنيوم والزنك ولا يتفاعل مع النحاس .
ينتج عن تفاعل حمض الكلوريدريك مع الفلزات تكون غاز وتحول الفلز الى ايونات .
الغاز المتصاعد هو ثنائي الهيدروجين ونرمز له ب H2 الذي يحدث فرقعة عند تقريبه من لهب .
ملخص هذه التفاعلات :
الفلز + حمض الكلوريدريك ---------> ثنائي الهيدروجين + ايونات الفلز
5) صياغة المعادلات الكيميائية :
معادلات التفاعلات الكيميائية :
معادلة تفاعل الحديد مع حمض الكلوريدريك :
معادلة تفاعل الزنك مع حمض الكلوريدريك :
معادلة تفاعل الألمنيوم مع حمض الكلوريدريك :
تطبيق 1 :
نريد حفظ محلول حمض الكلوريدريك المركز في أوان نتوفر على أوان من البلاستيك، النحاس و الألمنيوم .
حدد معللا جوابك الإناء المناسب لحفظ هذا المحلول ؟
تطبيق 2 :
نصب كمية من محلول حمضي في كاس بها مسامير من حديد .
1) ماذا نلاحظ عند بداية التجربة ؟
2) ما هي نواتج هذا التفاعل؟
3) اكتب معادلة التفاعل ؟
تصحيح تطبيق 1 :
لا يجب حفظ حمض الكلوريدريك في أوان من الألمنيوم لأنها تتفاعل معه .
يجب حفظ حمض الكلوريدريك في أوان من البلاستيك والنحاس لأنها لا تتفاعل معها .
تصحيح تطبيق 2 :
1) نلاحظ في بداية التجربة تصاعد فقاعات .
2) نواتج هذا التفاعل غاز ثنائي الهيدروجين وتكون ايونات الحديد الثاني التي تعطينا تلونا اخضر .
3) معادلة تفاعل الحديد هي :
IV) تأثير هيدروكسيد الصوديوم على الفلزات .
تعريف حمض هيدروكسيد الصوديوم :
محلول هيدروكسيد الصوديوم محلول قاعدي له PH>7 يتكون من أيونات +Na وايونات -OH صيغته (-Na+ ، OH)
2) تجربة :
نصب قليلا من محلول هيدروكسيد الصوديوم على أنابيب تحتوي على فلزات .
2) ملاحظة :
عدم تصاعد الفقاعات في الأنبوبين الذين يحتويان على الحديد والنحاس .
تصاعد فقاعات في الأنبوب الذي يحتوي على الألمنيوم في درجة حرارة عادية .
تصاعد فقاعات في الأنبوب الذي يحتوي على الزنك بعد التسخين .
3) استنتاج :
لا يتفاعل هيدروكسيد الصوديوم مع الحديد والنحاس .
تصاعد فقاعات يدل على حدوث تفاعل وتكون غاز .
4) خلاصة :
يتفاعل محلول هيدروكسيد الصوديوم مع الألمنيوم ومع الزنك بعد التسخين،
وينتج عن هذا التفاعل غاز ثنائي الهيدروجين وتحول الفلز إلى ايونات ؛
لا يتفاعل محلول هيدروكسيد الصوديوم مع الحديد، النحاس، البلاستيك والزجاج ؛
تطبيق :
نتوفر على محلولين احدهما حمضي والآخر قاعدي .
أعط طريقتين مختلفتين للتمييز بينهما ؟
تصحيح التطبيق :
الطريقة الأولى : قياس PH سواء باستعمال PH متر او ورق PH ،
إذا كان PH<7 فان المحلول حمضي، وإذا كان PH>7 فان المحلول قاعدي .
الطريقة الثانية : استعمال فلز الحديد .
نصب المحلولين في كأسين بهما فلز الحديد،
إذا لاحظنا تصاعد فقاعات فان المحلول الذي في الكأس حمضي وإذا لم تتصاعد فان المحلول قاعدي .
V) روائز الكشف عن بعض الايونات :
نحضر 3 محاليل : محلول الملح، محلول كبريتات النحاس الثالث ومحلول كبريتات الحديد الثاني .


1) مما تتكون المحاليل ؟
2) ما هو الفرق بين هذه المحاليل ؟
تتكون المحاليل من ايونات موجبة وايونات سالبة شحنة الايونات الموجبة تعادل شحنة الايونات السالبة .
تختلف هذه المحاليل من حيث اللون، فمحلول الملح عديم اللون، كبريتات الحديد الثاني لونه أخضر بينما كبريتات النحاس الثالث له لون أزرق تختلف ألوان المحاليل بسبب اختلاف الأيونات المتواجدة بها فبعض الأيونات تعطي ألوانا مثل +Fe 2 و+Cu 2 وأخرى لا تعطي ألوانا مثل +Na و-Cl .
1) روائز الكشف عن الأيونات الموجبة ( الكاتيونات )
المحلول الكاشف هو هيدروكسيد الصوديوم (-Na+ ، OH) وهو المستعمل للكشف عن جميع الايونات الموجبة .
أ) روائز الكشف عن ايونات الحديد الثاني +Fe 2 وايونات الحديد الثالث +Fe 3 :
نصب قليلا من هيدروكسيد الصوديوم (-Na+ ، OH) في محلولين : كبريتات الحديد الثاني ومحلول كلورور الحديد الثالث
الراسب الاخضر يسمى هيدروكسيد الحديد الثاني صيغته : Fe(OH)2 ، ويدل على وجود ايونات الحديد الثاني في المحلول، معادلة هذا الترسيب هي :
الراسب الذي له لون الصدأ يسمى هيدروكسيد الحديد الثالث صيغته : Fe(OH)3 ، ويدل على وجود ايونات الحديد الثالث في المحلول، معادلة هذا الترسيب هي :
ب) روائز الكشف عن ايونات النحاس الثاني +Cu2 :
نصب قليلا من محلول هيدروكسيد الصوديوم على محلول كبريتات النحاس الثاني
الراسب الأزرق يسمى هيدروكسيد النحاس الثاني صيغته : Cu(OH)2 ، ويدل على وجود ايونات النحاس الثاني في المحلول، معادلة هذا الترسيب هي :
ج) روائز الكشف عن ايونات الألمنيوم +Al3 وايونات الزنك +Zn2 :
الراسب الأبيض الذي يذوب بعد إضافة كمية وافرة من هيدروكسيد الصوديوم يسمى هيدروكسيد الزنك صيغته : Zn(OH)2 ، ويدل على وجود أيونات الزنك في المحلول، معادلة هذا الترسيب هي :
الراسب الأبيض الذي لا يذوب يسمى هيدروكسيد الألمنيوم صيغته : Al(OH)3 ، ويدل على وجود أيونات الألمنيوم في المحلول، معادلة هذا الترسيب هي :
د) رائز الكشف عن ايونات الكلورور -Cl :
الراسب الأبيض الذي يسود تحت تأثير الضوء يسمى كلورور الفضة صيغته :Agcl، ويدل على وجود أيونات الكلورور في المحلول، معادلة هذا الترسيب هي :


























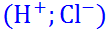
















%2B%D8%A7%D9%84%D9%85%D8%AA%D8%B9%D8%A7%D9%85%D8%AF%2B%D9%88%D8%A7%D9%84%D9%85%D9%85%D9%86%D8%B8%D9%85.png)

0 التعليقات:
إرسال تعليق